Ποια χρονική στιγμή κρίνεται κατάλληλη για την έναρξη της θεραπείας;
Αμέσως μόλις γίνει διάγνωση για NTM-PD, θα πρέπει να εφαρμοστεί ένα θεραπευτικό σχήμα.
Σύμφωνα με τις κατευθυντήριες οδηγίες για τη θεραπεία NTM του 2020 συστήνεται η άμεση χορήγηση αντιβιοτικής αγωγής στους ασθενείς που πληρούν τα διαγνωστικά κριτήρια για NTM (κλινικά, απεικονιστικά και μικροβιολογικά) αντί να τηρείται στάση αναμονής.1,2 Αυτό ισχύει ειδικότερα για ασθενείς με θετική οξεάντοχη χρώση και/ή παρουσία κοιλότητας στον πνεύμονα.
Ωστόσο, η απόφαση για έναρξη θεραπείας θα πρέπει να εξατομικεύεται και να βασίζεται σε μια σειρά παραγόντων από τους οποίους εξαρτώνται τόσο το πιθανό κόστος όσο και τα οφέλη της θεραπείας για τον ασθενή. Σε αυτούς συμπεριλαμβάνονται οι ακόλουθοι:
- Κλινικοί παράγοντες, μεταξύ άλλων, η παρουσία κοιλοτήτων στους πνεύμονες και υποκείμενες συννοσηρότητες
- Το είδος του μυκοβακτηριδίου – η λοιμογονικότητα μεταξύ των ειδών NTM διαφέρει: ξεκινήστε να χορηγείτε αντιβιοτική αγωγή στους ασθενείς στους οποίους απομονώνονται είδη με κλινική σημασία, συμπεριλαμβανομένου του συμπλέγματος MAC3,4
- Οι προτεραιότητες και οι επιθυμίες του ασθενή
Για παράδειγμα, σε ασθενείς με πνευμονική νόσο από M. kansasii, όπου συνιστάται επιθετική αγωγή λόγω της λοιμογονικότητας του M. kansasii, η προοδευτική απεικονιστική εξέλιξη μπορεί να είναι εξαιρετικά ταχεία, με μία μελέτη να καταδεικνύει προοδευτική εξέλιξη στο 63% των ασθενών εντός του πρώτου έτους από τη διάγνωση, με θνητότητα που αγγίζει το 43% και διάμεση επιβίωση 71 ημέρες στην περίπτωση που οι ασθενείς δεν λάβουν θεραπευτική αγωγή.5 Αντιθέτως, στην περίπτωση που υπήρξε έναρξη αποτελεσματικής θεραπευτικής αγωγής, ο ρυθμός εξέλιξης ήταν σχεδόν 4 φορές μικρότερος (μόνο το 16% των ασθενών είχε προοδευτική εξέλιξη της νόσου p<0,001).5
Παρομοίως, στη MAC-PD, σε μία μελέτη, η καθυστέρηση στη χορήγηση θεραπείας συσχετίστηκαν με προοδευτική εξέλιξη της νόσου σε όλους σχεδόν τους ασθενείς (97,5%) εντός 6 ετών, με σημαντική αύξηση σε κοιλότητες, σχηματισμό οζιδίων και εμφάνιση πύκνωσης.6
Αξίζει να θυμάστε ότι ορισμένοι ασθενείς σε αυξημένο κίνδυνο για νόσηση από NTM-PD, πιθανά ήταν συμπτωματικοί για δέκα και περισσότερα έτη προ της διάγνωσης.7
Στη θεραπευτική αντιμετώπιση της NTM-PD εμπλέκονται πολλοί παράγοντες και είναι σημαντικό να διασφαλίσετε ότι πνευμονικές παθήσεις ή άλλες συννοσηρότητες αντιμετωπίζονται με τον καλύτερο τρόπο και ότι παρακολουθούνται θέματα όπως απώλεια βάρους, δίαιτα και διατροφή, κατάθλιψη και διαταραχές του ύπνου.
Οι αποφάσεις που αφορούν τη θεραπευτική αντιμετώπιση της NTM-PD είναι συχνά δύσκολες και απαιτούν εμπειρία στη διαχείριση της νόσου. Σκεφτείτε την παραπομπή σε εξειδικευμένο κέντρο ή την παροχή συμβουλευτικής από έμπειρους συναδέλφους.1




Ποια είναι η κατάλληλη θεραπευτική αντιμετώπιση;
Θεραπευτική αντιμετώπιση της NTM - PD: από τις μη φαρμακολογικές πιθανές επιλογές έως το χειρουργείο
Για την αποτελεσματική αντιμετώπιση της NTM-PD, θα πρέπει να εξετάζονται όλες οι διαθέσιμες επιλογές, από τη μη φαρμακολογική κάθαρση των αεραγωγών έως την αντιβιοτική θεραπεία και το χειρουργείο.1,8,9
Οι ασθενείς συχνά αντιμετωπίζουν ένα μακρύ ταξίδι έως τη διάγνωση και η θεραπευτική αντιμετώπιση της NTM-PD μπορεί να είναι εξαιρετικά επίπονη, με μακροχρόνια και πιθανώς περίπλοκα δοσολογικά σχήματα που συσχετίζονται με ανεπιθύμητες ενέργειες και κακή συμμόρφωση του ασθενή.10
Είναι γνωστό ότι οι ασθενείς με NTM-PD βιώνουν μια προοδευτική πτώση της ποιότητας ζωής (HRQoL) λόγω της νόσου και των θεραπευτικών επιλογών. Επομένως, το να τους ενημερώσετε για το τι θα πρέπει να προσδοκούν κατά την έναρξη της θεραπείας έχει κρίσιμη σημασία για την επιτυχία της.11
Η κάθαρση των αεραγωγών έχει ζωτική σημασία σε όλα τα στάδια διαχείρισης της NTM-PD
H κάθαρση των αεραγωγών συνιστά μια σημαντική πτυχή της θεραπείας για όλους τους ασθενείς με NTM-PD, καθώς βοηθά στην αποβολή της βλέννης από τους πνεύμονες.
Μπορεί να βελτιώσει τον όγκο των εκκρίσεων που αποβάλλονται από τους πνεύμονες, τον βήχα, τη δύσπνοια και την ποιότητα ζωής (HRQoL).8
Οι τεχνικές για την κάθαρση των αεραγωγών περιλαμβάνουν:
- Υπέρτονο διάλυμα φυσιολογικού ορού σε μορφή εκνεφώματος
- Αναπνευστική φυσικοθεραπεία με την εφαρμογή χειρωνακτικών τεχνικών
- Κάθαρση μέσω συσκευών όπως συσκευές ταλαντώσεων και γιλέκα γεμάτα αέρα
- Τεχνικές αποτελεσματικού βήχα – τεχνική βήχα Huff
Αντιβιοτική αντιμετώπιση NTM-PD
Οι κατευθυντήριες οδηγίες που δημοσιοποιήθηκαν το 2020 παρέχουν στρατηγικές πολυφαρμακευτικής διαχείρισης ασθενών με λοίμωξη από NTM, ειδικότερα το σύμπλεγμα Mycobacterium avium (MAC), τα M. kansasii, M. xenopi και το M abscessus.1
Χειρουργική αντιμετώπιση για τη θεραπεία της NTM-PD
Συχνά, η NTM-PD είναι δύσκολο να αντιμετωπιστεί αποκλειστικά με αντιμικροβιακή αγωγή. Για επιλεγμένους ασθενείς, η χειρουργική εκτομή ίσως είναι κατάλληλη και θα πρέπει να εξετάζεται ως ενδεχόμενη μέθοδος αντιμετώπισης σε συνδυασμό με τη φαρμακευτική αγωγή.1,9
Η απόφαση για τη διεξαγωγή χειρουργικής εκτομής απαιτεί διαβούλευση με ειδικό. Ωστόσο, μελέτες αποδεικνύουν ότι τα ποσοστά αρνητικοποίησης της καλλιέργειας μετά το χειρουργείο είναι συγκρίσιμα με εκείνα που παρατηρούνται με την λήψη της αντιμικροβιακής αγωγής.1
Ανεξάρτητα από τις θεραπευτικές επιλογές, η συστηματική παρακολούθηση των ασθενών, συμπεριλαμβανομένων των τακτικών αναλύσεων δειγμάτων πτυέλων και της τακτικής κλινικής παρακολούθησης έχουν θεμελιώδη σημασία.
Δοκιμασία ευαισθησίας
Η κατανόηση των αποτελεσμάτων των δοκιμασιών ευαισθησίας των NTM στα βασικά αντιβιοτικά είναι κρίσιμης σημασίας για την επιτυχία της θεραπείας
Μόλις ληφθεί η απόφαση για τη θεραπευτική αντιμετώπιση της NTM-PD, συστήνεται να καθοριστεί η ευαισθησία του μικροοργανισμού στο φάρμακο πρώτης γραμμής.1 Η εξατομικευμένη θεραπεία με βάση τις δοκιμασίες ευαισθησίας προτιμάται και συστήνεται έναντι της εμπειρικής αγωγής.1,12
Η δοκιμασία ευαισθησίας δεν μπορεί να προβλέψει ποιοι ασθενείς με NTM-PD θα ανταποκριθούν στην αντιβιοτική αγωγή, αλλά είναι σημαντική για την λήψη τεκμηριωμένων θεραπευτικών αποφάσεων που αφορούν τη φαρμακευτική αγωγή και θα πρέπει να διεξάγεται πάντα για τους ασθενείς που αποτυγχάνουν να επωφεληθούν από τη θεραπεία.1,12
Οι κατευθυντήριες οδηγίες συνιστούν τις ακόλουθες δοκιμασίες ευαισθησίας, ανάλογα με τον λοιμογόνο μικροοργανισμό που ταυτοποιείται
- MAC-PD: μακρολίδες (αζιθρομυκίνη και κλαριθρομυκίνη) και αμικασίνη
- M. kansasii: ριφαμπικίνη
- M. Abscessus:: μακρολίδες και αμικασίνη και στην περίπτωση των μακρολίδων, να εκτιμάται η δυνητική επαγώμενης αντοχής στις μακρολίδες μέσω επώασης 14 ημερών και/ή αλληλούχισης (sequencing) του γονιδίου erm(41)
- M. xenopi: επί του παρόντος, δεν υπάρχουν επαρκή στοιχεία για να προταθεί μια συγκεκριμένη δοκιμασία ευαισθησίας
Στην περίπτωση αντοχής στις μακρολίδες, στο σχήμα προστίθεται η ενδοφλέβια χορήγηση αμικασίνης ή στρεπτομυκίνης.1 Και εδώ, είναι σημαντικό να καθοριστεί η ευαισθησία της αμικασίνης, καθώς οι ασθενείς με σοβαρή νόσο ή νόσο με ινωτικές και κοιλοτικές βλάβες θα πρέπει να λαμβάνουν ενδοφλεβίως αμικασίνη ή στρεπτομυκίνη επιπλέον της τυπικής τριπλής αντιβιοτικής αγωγής, κατά προτίμηση αζιθρομυκίνη, εθαμβουτόλη και ριφαμπικίνη, για τους πρώτους 2–3 μήνες της θεραπείας.
Για τους ασθενείς με αποτυχημένη ανταπόκριση στην από του στόματος τριπλή αγωγή με βάση τις κατευθυντήριες οδηγίες μετά από 6 μήνες, συνιστάται η χορήγηση εισπνεόμενης λιποσωμιακής αμικασίνης (ALIS). Τα όρια ευαισθησίας της ALIS είναι πολύ υψηλότερα από εκείνα της ενδοφλεβίως χορηγούμενης αμικασίνης (≥ 128 mg/L έναντι ≥64 mg/L).1,13,14
Σύμφωνα με τις πρόσφατες κατευθυντήριες οδηγίες για τη χρήση των μακρολίδων στις βρογχεκτασίες, μια συνήθης συννοσηρότητα της MAC-PD, όλοι οι ασθενείς θα πρέπει να θεωρούνται υποψήφιοι για λήψη μακρολίδων, με σκοπό την αντιμετώπιση ή τον περιορισμό των παροξύνσεων, καθώς και να ελέγχονται προληπτικά για ευαισθησία στα μακρολίδες και την παρουσία των NTM, ώστε στην περίπτωση που απομονωθεί NTM, οι μακρολίδες να παραμένουν ανάμεσα στις θεραπευτικές επιλογές.15
Κατευθυντήριες οδηγίες θεραπευτικής αντιμετώπισης
Η μακρά διαχείριση της NTM-PD εστιάζει στην έγκαιρη θεραπευτική αντιμετώπιση με αγωγή από του στόματος βασισμένη στις κατευθυντήριες οδηγίες
Η απόφαση για θεραπευτική αντιμετώπιση επηρεάζεται από τους ακόλουθους παράγοντες:
- την ταυτότητα του λοιμογόνου μυκοβακτηριδίου
- τη σοβαρότητα της NTM-PD
- τον κίνδυνο προοδευτικής εξέλιξης της νόσου
- την παρουσία συννοσηροτήτων
- τους στόχους της θεραπείας
Παρόλο που οι λόγοι δεν είναι πλήρως κατανοητοί, οι υψηλότερες πιθανότητες επιτυχούς θεραπείας για λοίμωξη από NTM, όπως στην περίπτωση της MAC-PD, παρατηρούνται στον πρώτο κύκλο χορήγησης αντιμικροβιακής αγωγής βασισμένης στις κατευθυντήριες οδηγίες.16 Η επιλογή της κατάλληλης θεραπείας για τον ασθενή σας έχει ζωτική σημασία, προκειμένου να βελτιωθούν οι πιθανότητες επιτυχούς έκβασης.
Οι κατευθυντήριες οδηγίες παρέχουν συστάσεις αναφορικά με τη θεραπευτική αντιμετώπιση εκείνων των μυκοβακτηριδιακών ειδών που είναι τα συνηθέστερα και σχετίζονται με την υψηλότερη παθογονικότητα – τα MAC, M. kansasii¸ M. xenopi και M. abscessus.1
Οι κατευθυντήριες οδηγίες θεραπευτικής αντιμετώπισης παρέχουν μια συνολική εικόνα με τις θεραπευτικές προσεγγίσεις για ευαίσθητους και ανθεκτικούς μικροοργανισμούς. Στην περίπτωση της MAC-PD, οι κατευθυντήριες οδηγίες παρέχουν επίσης συστάσεις για τη θεραπευτική αντιμετώπιση ασθενών στους οποίους δεν υπάρχει μετατροπή της καλλιέργειας στους 6 μήνες.1
Στους ασθενείς με ταυτοποίηση του M. kansasii , η θεραπεία θα πρέπει να ξεκινά μετά από μία μόνο θετική καλλιέργεια λόγω της υψηλής παθογονικότητας του μυκοβακτηριδίου.1 Οι ασθενείς με M. kansasii διατρέχουν υψηλό κίνδυνο θνητότητας εντός του πρώτου έτους από τη διάγνωση αν η νόσος δεν αντιμετωπιστεί.5 Σε αυτούς τους ασθενείς, για την αντιμετώπιση του M. kansasii συστήνεται η χορήγηση ριφαμπικίνης, εθαμβουτόλης και είτε μιας μακρολίδης είτε ισονιαζίδης, ενώ σε ασθενείς με παρουσία οζιδίων χωρίς κοιλότητες η χορήγηση μπορεί να είναι διαλείπουσα. Για τους ασθενείς με αντίσταση στη ριφαμπικίνη ή δυσανεξία σε κάποιο από τα φάρμακα πρώτης γραμμής, σκεφτείτε την προσθήκη μιας φθοριοκινολόνης όπως η μοξιφλοξασίνη.1
Στους ασθενείς με MAC-PD, εφόσον καθοριστεί η ευαισθησία, για την αρχική θεραπευτική αντιμετώπιση της νόσου, οι κατευθυντήριες οδηγίες συνιστούν τη χορήγηση τουλάχιστον τριών αντιβιοτικών από του στόματος – μια μακρολίδη (η αζιθρομυκίνη προτιμάται έναντι της κλαριθρομυκίνης), εθαμβουτόλη και ριφαμπικίνη, με την προσθήκη παρεντερικών αμινογλυκοσιδών για εκείνους με λοίμωξη ανθεκτική στις μακρολίδες.1
Για τους ασθενείς με MAC-PD στους οποίους η από του στόματος αγωγή βάσει των κατευθυντηρίων οδηγιών απέτυχε μετά από διάστημα ίσο ή μεγαλύτερο από 6 μήνες, καθώς και για τους ασθενείς με απομονωμένα στελέχη ευαίσθητα στην αμικασίνη, οι κατευθυντήριες οδηγίες συστήνουν αυστηρά την προσθήκη ALIS14 στο θεραπευτικό σχήμα.1 Τα όρια ευαισθησίας για την ALIS είναι ≥128 μg/mL σε σύγκριση με εκείνα της ενδοφλέβιας αμικασίνης που είναι ≥64 μg/mL.13
Στους ασθενείς με M. abscessus χωρίς επαγώμενη αντοχή, συνιστάται ένα πολυφαρμακευτικό σχήμα που να περιέχει μακρολίδη.. Παρομοίως, σε εκείνους με επαγώμενη αντοχή στις μακρολίδες, συνεχίστε να περιλαμβάνετε μια μακρολίδη, για τις ανοσορυθμιστικές του ιδιότητες μόνο συνδυαστικά με ένα σχήμα άλλων δραστικών αντιμικροβιακών φαρμάκων.1 Το Το Μ.abscessus έχει συσχετιστεί με υψηλά ποσοστά θνητότητας και αντοχή στα αντιμικροβιακά.17,18
Για τους ασθενείς με λοίμωξη από το M. xenopi, η θεραπεία θα πρέπει να ξεκινά με ένα πολυφαρμακευτικό σχήμα με τουλάχιστον 3 αντιμικροβιακά το οποίο θα περιλαμβάνει τη μοξιφλοξασίνη ή μία μακρολίδη, καθώς και ριφαμπικίνη και εθαμβουτόλη.1 Καθώς το M. xenopi συνδέεται με ένα υψηλό ποσοστό θνητότητας, θα πρέπει να χρησιμοποιείται σχήμα τουλάχιστον 3 φαρμάκων, στο οποίο θα προστίθεται και η παρεντερική αμικασίνη για όσους παρουσιάζουν κοιλότητα.1
Τα δεδομένα αποδεικνύουν ότι, σε ασθενείς με NTM-PD που δεν οφείλεται σε MAC, η από του στόματος αγωγή βάσει των κατευθυντηρίων οδηγιών αποτυγχάνει στο 34% των ασθενών8, ενώ σε εκείνους με MAC-PD το ποσοστό αποτυχημένης έκβασης μπορεί να ανέλθει έως και το 45%.20–22
Κατά τη διάρκεια της θεραπείας, ο ασθενής θα πρέπει να παρακολουθείται στενά, ώστε να εκτιμηθεί η χρονική στιγμή αρνητικοποίησης της καλλιέργειας. Προϋποθέσεις για την επιτυχή θεραπεία της NTM-PD είναι οι ακόλουθες:1,2
- Παρακολούθηση μέσω της αξιολόγησης συχνών καλλιεργειών πτυέλων
- Κλινική βελτίωση εντός 3–6 μηνών
- Αρνητικοποίηση της καλλιέργειας εντός 6 μηνών από την έναρξη χορήγησης κατάλληλης αντιβιοτικής αγωγής
- Σταθερή στο χρόνο μετατροπή (αρνητικοποίηση) της καλλιέργειας
Μετά την αρνητικοποίηση της καλλιέργειας, οι κατευθυντήριες οδηγίες συνιστούν τη συνέχιση της θεραπείας για τουλάχιστον 12 μήνες ακόμα για ασθενείς με λοίμωξη από MAC, M. kansasii και M. xenopi, ενώ στην περίπτωση του M. abscessus, προκειμένου να καθοριστεί η διάρκεια της θεραπείας, συνιστάται η λήψη συμβουλής από ειδικό.12
Συνεχής διαχείριση της νόσου
 Η παρακολούθηση του ασθενή, καθώς και η συνέχιση της θεραπείας για 12 μήνες μετά το σημείο αρνητικοποίησης της καλλιέργειας έχει κρίσιμη σημασία για την επιτυχή διαχείριση της NTM-PD σε συνεχή βάση
Η παρακολούθηση του ασθενή, καθώς και η συνέχιση της θεραπείας για 12 μήνες μετά το σημείο αρνητικοποίησης της καλλιέργειας έχει κρίσιμη σημασία για την επιτυχή διαχείριση της NTM-PD σε συνεχή βάση
Η προληπτική διαχείριση είναι το κλειδί για την επιτυχία της θεραπείας στη NTM-PD. Η παρακολούθηση και η υποστήριξη των ασθενών στη διάρκεια της θεραπείας πρέπει να εστιάζουν στις κλινικές πτυχές της νόσου, αλλά και σε θέματα που σχετίζονται με τον ασθενή.
Για να παρακολουθείται η πορεία των ασθενών, οι καλλιέργειες πτυέλων πρέπει να αξιολογούνται τακτικά, κάθε 1–2 μήνες, και εφόσον υπάρξει μετατροπή τους, η θεραπεία θα πρέπει να συνεχίζεται για 12 μήνες ακόμα.1,23 Στη διάρκεια αυτού του διαστήματος, θα πρέπει να συνεχίσουν να συλλέγονται διαδοχικές καλλιέργειες πτυέλων εάν υπάρχει ιατρική ένδειξη, ακόμη και κάθε 4-12 εβδομάδες.24 Η πορεία της νόσου, όπως και η επιτυχής έκβαση της θεραπείας εξαρτώνται από έναν συνδυασμό κλινικών, μικροβιολογικών και απεικονιστικών παραμέτρων, με στόχο την αξιολόγηση των συμπτωμάτων, των δειγμάτων πτυέλων, της αναπνευστικής λειτουργίας και της δομικής βλάβης.1,25
Πέρα από την ειδική θεραπεία για τη NTM-PD, η κατάσταση του ασθενή θα πρέπει να εκτιμάται σφαιρικά. Είναι γνωστό ότι τα ανοσοκατασταλτικά φάρμακα, όπως τα εισπνεόμενα κορτικοστεροειδή ή οι βιολογικοί παράγοντες αποτελούν παράγοντα κινδύνου για νόσηση από NTM. Επιπρόσθετοι προδιαθεσιακοί παράγοντες κινδύνου είναι ο χαμηλός δείκτης BMI, το γυναικείο φύλο, η ανεπάρκεια σε βιταμίνη D και υποκείμενα νοσήματα όπως βρογχεκτασίες, η ΧΑΠ, η ΓΟΠ, ο διαβήτης και η χρόνια νεφρική νόσος.25 Για τον περιορισμό και τη διαχείριση ορισμένων από τα παραπάνω, κρίνεται σκόπιμη η προσέγγιση από διεπιστημονική ομάδα.25
Η διεπιστημονική ομάδα αποτελείται από πνευμονολόγο, ακτινολόγο και μικροβιολόγο. Ωστόσο, καθώς πρόκειται για μια χρόνια νόσο με διάρκεια θεραπείας άνω του ενός έτους, έχει προταθεί η διεπιστημονική ομάδα να περιλαμβάνει έναν εξειδικευμένο νοσηλευτή, καθώς οι ασθενείς χρειάζονται συνεχή υποστήριξη.25 Η αποτελεσματική υποστήριξη των ασθενών μπορεί να βελτιώσει τη συμμόρφωσή τους στη θεραπεία, τόσο κατά τις επισκέψεις στο ιατρείο όσο και κατά την εξ αποστάσεως επικοινωνία μέσω τηλεφώνου ή online συνεδριών.
Η καταπολέμηση της προοδευτικής έκπτωσης της αναπνευστικής λειτουργίας συνιστά κρίσιμο στοιχείο στην κλινική φροντίδα της NTM-PD και καθ’ όλη την πορεία της νόσου, στους ασθενείς θα πρέπει να προσφέρεται η βοήθεια ενός φυσικοθεραπευτή για την κάθαρση των αεραγωγών από τις εκκρίσεις.25 Παρομοίως, καθώς η NTM-PD συνδέεται με χαμηλό δείκτη BMI25,26, είναι σημαντικό να γίνονται βελτιώσεις στη διατροφή. Η επίδραση της νόσου στην ποιότητα ζωής ενός ασθενή δεν θα πρέπει να υποτιμάται, συνεπώς οι παρεμβάσεις από ψυχολόγο θα πρέπει να εξετάζονται ως ενδεχόμενο, για μεμονωμένους ασθενείς, όπως και η παροχή υποστήριξης από τοπικούς/ εθνικούς συλλόγους ασθενών.25
Για τους ασθενείς που λαμβάνουν αρχική αντιμικροβιακή αγωγή από του στόματος βάσει κατευθυντηρίων οδηγιών, οι μελέτες έχουν υποδείξει ότι τα ποσοστά επιτυχούς έκβασης κυμαίνονται, ανάλογα με το είδος NTM, από 32% έως 80% (32% M. xenopi, 41%, MABC, 66% για το MAC, 80% M. kansasii).27,28
Σχετικές πηγές

Βίντεο
Κατευθυντήριες οδηγίες ATS/ERS/ESCMID/IDSA για τη NTM-PD 2020 – Παρουσίαση ειδικών
Stefano Aliberti, Christoph Lange, Eva Polverino, Nicolas Veziris, Charles Haworth and Jakko van Ingen
Η πνευμονική νόσος από μη φυματικά μυκοβακτηρίδια (NTM-PD) εμφανίζεται όλο και συχνότερα και μπορεί να οδηγήσει στον θάνατο. Οι διεθνείς κατευθυντήριες οδηγίες του 2020 παρέχουν συστάσεις σχετικά με τα τέσσερα συχνότερα λοιμογόνα είδη NTM.

Άρθρο
Read time: 7 mins
Η πνευμονική νόσος που οφείλεται στο σύμπλεγμα άτυπων μυκοβακτηριδίων MAC (MAC-PD) παρουσιάζει προβλήματα στη διάγνωση, καθώς τα συμπτώματα είναι παρόμοια με εκείνα υποκείμενων πνευμονικών νοσημάτων.

Άρθρο
Read time: 5 mins
Η αντιμετώπιση της πνευμονικής νόσου από μη φυματικά μυκοβακτηρίδια (NTM-PD) με αντιμικροβιακούς παράγοντες προσφέρει τη δυνατότητα της ίασης. Σε ασθενείς που πληρούν τα κλινικά, απεικονιστικά και μικροβιολογικά διαγνωστικά κριτήρια για NTM-PD.

Βίντεο
Τι πρέπει να γίνει στην περίπτωση αποτυχίας της θεραπείας
Σε αυτό το βίντεο, ειδικοί διερευνούν τις επιλογές που έχουν οι ιατροί για τη MAC-PD όταν η θεραπεία αποτυγχάνει.

Βίντεο
Η απόφαση για το ποια είναι η κατάλληλη στιγμή για την έναρξη της θεραπείας στη MAC-PD εξαρτάται από πολλούς παράγοντες. Σε αυτό το βίντεο, ειδικοί διερευνούν το σκεπτικό και το χρονικό πλαίσιο για την έναρξη της θεραπείας.

Βίντεο
Συνεχής διαχείριση ασθενών με MAC-PD
Δείτε και ακούστε διεθνείς ειδικούς να διερευνούν τα βασικά στοιχεία στην εφαρμοζόμενη θεραπευτική μεταχείριση έως τη μετατροπή της καλλιέργειας και μετά από αυτήν.

Βίντεο
Κατευθυντήριες οδηγίες ATS/ERS/ESCMID/IDSA για τη NTM-PD 2020 – Παρουσίαση ειδικών
Stefano Aliberti, Christoph Lange, Eva Polverino, Nicolas Veziris, Charles Haworth and Jakko van Ingen
Η πνευμονική νόσος από μη φυματικά μυκοβακτηρίδια (NTM-PD) εμφανίζεται όλο και συχνότερα και μπορεί να οδηγήσει στον θάνατο. Οι διεθνείς κατευθυντήριες οδηγίες του 2020 παρέχουν συστάσεις σχετικά με τα τέσσερα συχνότερα λοιμογόνα είδη NTM.
Μάθετε περισσότερα για την NTM-PD
Μη φυματικά μυκοβακτηρίδια (NTM)
Σκεφτείτε τις ανεκπλήρωτες ανάγκες του κλινικού ιατρού και του ασθενή
Μια συλλογή πηγών στην οποία μπορείτε να εκτελέσετε αναζήτηση και που περιλαμβάνει, μεταξύ άλλων, περιλήψεις πρόσφατων δημοσιεύσεων
Ελέγξτε τις γνώσεις σας σχετικά με τα NTM
Συμμετάσχετε και ελέγξτε τις γνώσεις σας για τη διαχείριση της NTM-PD
Βιβλιογραφία:
- Daley CL et al. Eur Respir J 2020;56:2000535.
- Griffith DE et al. Am J Respir Crit Care Med 2007;175:367–416.
- Fleschner M et al. Int J Tuberc Lung Dis 2016;20:582–7.
- Zweijpfenning S et al. Semin Respir Crit Care Med 2018;39:336–42.
- Liu C-J et al. Respir Med 2019;151:19–26.
- Park TY et al. PLoS One 2017;12:e0185774.
- Kotilainen H et al. Eur J Clin Microbiol Infect Dis 2015;34:1909–18.
- Lan C-C et al. J Formosan Med Assoc 2020;119:S42–S50.
- Yu JA et al. Thorac Surg Clin2012;22(3):277–85.
- Chalmers et al. ERJ Open Research 2020;6: 00317-2020
- Henkle E et al. Eur Respir J 2020;55:1901300.
- Haworth C et al. Thorax 2017;72(Suppl 2):ii1–ii64.
- Clinical and Laboratory Standards Institute. M48 - laboratory detection and identification of mycobacteria, 2nd edition 2018.
- ARIKAYCE liposomal. European Summary of Product Characteristics October 2020. Available at: https://www.ema.europa.eu/en/documents/product-information/arikayce-liposomal-product-information_en.pdf [Accessed April 2021]
- Smith D et al. BMJ Open Respiratory Res 2020;7:e000489.
- Griffith DE et al. Curr Opin Infect Dis 2012;25:218–27.
- Jhun BW et al. Eur Respir J 2020;55:1900798.
- Sfeir M et al. Open Forum Infect Dis 2018;5(2):ofy022.
- Aliberti S et al. Respir Med 2020 Absract.
- Fukushima J et al. J Clin Med 2020;9:1315.
- Wallace RJ et al. Chest 2014;146:276–82.
- Diel R et al. Chest 2018;153:888–921
- Daley CL. Microbio Spectr 2017;5:1–36.
- Whitehead N. Nursing Times 2021;117;4:40–42.
- Lipman M et al. BMJ Open Resp Res 2020;7:e000591.
- Prevots DR et al. Clin Chest Med 2015;36:13–34.
- Diel R et al. Eur Resp J 2017;49:1602109.
- Diel R et al. BMC Infect Dis 2018;18:206.
An overview of the rationale and approach to diagnosis of Mycobacterium avium complex pulmonary disease (MAC-PD)
Mycobacterium avium complex pulmonary disease (MAC-PD) is difficult to diagnose with symptoms similar to underlying lung conditions.1 Correct, early diagnosis and treatment are paramount to prevent disease progression.1–4 The 2020 international guidelines recommend clinical, radiographical and microbiological diagnostic criteria for non-tuberculous mycobacterial pulmonary disease (NTM-PD) to facilitate timely and appropriate treatment.5
NTM-PD: an overlooked disease caused by ubiquitous mycobacteria
Non-tuberculous mycobacteria pulmonary disease (NTM-PD) is a chronic and potentially debilitating disease.6–10 Mycobacteria are ubiquitous in the environment11–13 and comprise almost 200 species and subspecies that can cause opportunistic infections in both pulmonary and extrapulmonary sites.5 NTM infections can be difficult to diagnose and treat and are particularly prevalent in those with lung damage or disease, cancer and immunodeficiencies.14
A series of 12 molecularly related Mycobacterium species have been identified that together comprise the Mycobacterium avium complex (MAC).15 Within MAC, the two most clinically relevant species are M. avium and M. intracellulare.16,17 MAC is the most common cause of NTM.18
Figure 1. Worldwide distribution of respiratory NTM isolates.
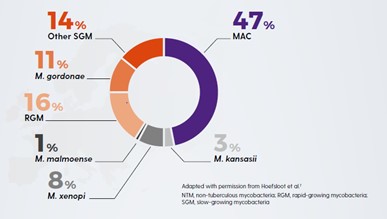
(Adapted from Hoefsloot, 2013)18
Increasing prevalence of NTM-PD
The incidence and prevalence of NTM-PD is increasing in many parts of the world.1,5,19,20 This may reflect increased awareness of the importance of NTM,1 the incidence of risk factors such as chronic obstructive pulmonary disease (COPD) and bronchiectasis,21,22 the use of immunosuppressive treatments,23 testing for NTM-PD and the effectiveness of diagnostic tools.1,17,24 NTM should be ruled out in at-risk patients to identify infection early and begin treatment in appropriate patients before there is disease progression.
Early diagnosis of NTM-PD is paramount to prevent disease progression.
NTM-PD is associated with increased mortality and morbidity – increasing the risk of pulmonary exacerbations9, lung cancer25 and other lung infections26 (e.g. tuberculosis [TB], aspergillosis) and atrial fibrillation.27 NTM-PD is difficult to diagnose as the symptoms of NTM-PD – cough, fatigue, haemoptysis, weight loss – are similar to underlying lung conditions.1 Many patients with NTM-PD may experience symptoms for >10 years before diagnosis.28 Correct, early diagnosis and treatment are paramount to prevent disease progression.1–4 One study has shown that without treatment, 97.5% (n=39/40) of MAC-PD patients will have disease progression within 6 years.17 Another study showed that for those with M. kansasii progression can be very rapid in untreated patients within 1 year (progression in up to 63% of patients) and a median survival of 71 days.29 Late diagnosis, misdiagnosis or inappropriate management of NTM-PD is likely to increase the risk of deterioration in lung health and health-related quality of life.
NTM-PD – not all species are equal
Not all NTM species will cause disease, and when they do, they may not need to be treated.1,30 Likewise the geographical distribution of species differs, driving local epidemiology. Knowledge of the local situation and species virulence is essential for daily clinical practice. MAC is most frequently associated with NTM-PD across all continents with M. avium causing about 63% of infections meeting ATS/IDSA criteria for treatment and M. intracellulare about 88%. Species such as M. gordonae are rarely clinically relevant.30
Who is at risk of NTM-PD?
For many at-risk patients NTM-PD symptoms are similar to symptoms of coexisting lung disease.1 These include chronic cough, fatigue, weight loss and low-grade fever.
Patients most at risk of developing NTM-PD include those with:
- Lung diseases e.g. bronchiectasis, COPD, asthma, prior TB.31–34
- Diseases/disorders causing structural lung damage e.g. cystic fibrosis, rheumatoid arthritis, genetic mutation.35–38
- Thoracic skeletal abnormalities – scoliosis, kyphosis, pectus excavatum:39,40 five times more likely to have NTM.34
- Diseases/disorders reducing cell-mediated immunity e.g. HIV AIDS, cancer, genetic mutation.37,38,41
- Therapies resulting in immunodeficiency e.g. organ transplant, anti-tumour necrosis factor (TNF) therapy, corticosteroids, immunosuppressants.34–36,41–44
- Marfanoid body habitus/Lady Windermere syndrome39,40,45 – tall, slender elderly patients with a below normal body mass index (BMI) (<18 Kg/m2) are three times more like to have NTM.34
|
Factors increasing susceptibility to NTM-PD |
Risk* |
|
Bronchiectasis32,47 |
44.0–187.5 |
|
Low BMI47 |
9.1 |
|
Cystic fibrosis65,66 |
6.6–13.0 |
|
COPD47 |
2.0–10.0 |
|
Thoracic skeletal abnormalities47 |
5.4 |
|
Asthma67 |
2.0 |
|
Steroid use47 |
1.6–8.0 |
|
GORD47 |
1.5–5.3 |
|
Immunomodulatory/immunosuppressant therapies47 |
1.3–2.2 |
* Relative risk, odds ratio or relative prevalence
Rates of NTM-PD are high in older individuals and those with underlying bronchiectasis.46,47 Many patients with bronchiectasis also have COPD (36–51%) or asthma (28–42%).23
In which patients should I rule out NTM?
NTM-PD should be ruled out in patients with underlying structural lung disease who:
- are being considered for long-term macrolide therapy to reduce exacerbations48
- are already receiving long-term macrolide therapy48
- present with worsening symptoms despite treatment optimisation49
- present with new pulmonary and non-specific systemic symptoms (e.g. chronic cough, fatigue, fever or dyspnoea).49
MAC-PD: difficult to treat
MAC-PD can be difficult to treat; MAC organisms evade host defences; they accumulate in biofilms and their uptake in macrophages gives them a place to hide from many antibiotics, which have poor penetration of these cells.50–54 Once inside macrophages, MAC limits normal macrophage function and reproduces unhindered, ready to trigger macrophage destruction so MAC bacteria can be released to infect the lung and invade other macrophages.55–57
Diagnostic criteria for MAC-PD
The 2020 international guidelines recommend that MAC-PD is diagnosed with either X-ray or computed tomography (CT) scan and the presence of MAC-positive sputum on multiple occasions. For radiological evidence of MAC-PD, either nodular or cavitary opacities on a chest radiograph, or bronchiectasis with multiple small nodules on a high-resolution CT scan is required. For microbiological confirmation, the 2020 guidelines recommend:5,19
- >1 positive sputum culture (to avoid spurious results from environmental contamination) with >3 respiratory samples collected over 1 week (to distinguish MAC-PD from occasional presence of MAC in the tracheobronchial tract).
- If sputum specimens are not obtainable, bronchoalveolar lavage fluid/bronchial washing cultures can be used to diagnose nodular/bronchiectatic NTM disease.
- Transbronchial or other lung biopsy with mycobacterial histologic features e.g., granulomatous inflammation or acid-fast bacilli (AFB) and positive culture for NTM or biopsy and one or more culture positive sputum or bronchial washings
Species identification helps determine clinical relevance and treatment selection.1,30 Where the same species is isolated in ≥2 sputum cultures over an interval of ≥1 week, there is a 98% likelihood of clinically significant MAC.
Following confirmation of a MAC-PD infection and the decision to treat, the next step is to test for antibiotic susceptibility5 to facilitate the selection of appropriate antimicrobial therapy.
Decision to treat MAC-PD
The decision to initiate antibiotic therapy for MAC-PD should not be based on diagnostic criteria alone.5,19 It is influenced by the severity of the disease, risk of disease progression, species/pathogenicity of infecting Mycobacterium, drug susceptibility, presence of comorbidity and the goals of treatment.1,5,19
Factors favouring treatment include those associated with poor prognosis (e.g. cavitary disease, low BMI, low albumin and elevated inflammatory markers), isolation of a species that is virulent and/or responsive to antimicrobial therapy, underlying immune suppression and major symptoms causing decreased health-related quality of life (e.g. fatigue).5,19 International NTM management guidelines recommend early treatment, as the benefits may outweigh the risks.5 Patients with NTM may already have a high treatment burden from their underlying chronic condition58–60 which could lead to a reluctance to add to it by starting treatment for NTM-PD immediately. However, with evidence from a study which suggests that left untreated, MAC-PD will progress,17 and increase risk of all-cause mortality27,61 and morbidity6–9,62 lowering patient quality of life,26,63 prompt treatment is essential.
Summary
Understanding which patients with underlying lung conditions are at risk of developing MAC-PD is important in order to deliver prompt and effective therapy. Treatment for MAC-PD is most successful at first initiation1 and a study has shown that refractory disease is associated with use of non-standard treatment regimens as outlined in the guidelines.64
Understanding the need to identify at-risk patients, implement effective diagnostic protocols and prompt robust therapy is a medical imperative with the potential to reduce patient mortality and morbidity.
Βιβλιογραφία:
- Griffith DE, et al. Am J Respir Crit Care Med 2007;175:367–416.
- Eikhani MS, et al. BMC Infect Dis 2018;18:311.
- Maiga M, et al. PLoS One 2012;7:e36902.
- Wagner D, et al. Poster presented at: European Respiratory Society Annual Congress 6–10 September 2014; Munich, Germany. P1067.
- Daley CL, et al. Eur Respir J 2020b;56(1):2000535.
- Park HY, et al. Chest 2016;150:1222–32.
- Kobayashi T, et al. J Clin Tuberc Other Mycobact Dis 2018;11:17–21.
- Lee MR, et al. PLoS One 2013;8:e58214.
- Huang CT, et al. Int J Tuberc Lung Dis 2012;16:539–45.
- Marras TK, et al. Emerg Infect Dis 2017;23:468–76.
- Falkinham JO. J Appl Microbiol 2009;107:356–671.
- Falkinham JO. Clin Chest Med 2015;36:35–41.
- Nishiuchi Y, et al. Front Med 2017;4:27.
- Ratnatunga CN, et al. Front Immunol 2020;11:303.
- van Ingen J, et al. Int J Syst Evol Microbiol 2018;68:3666–77.
- Boyle DP, et al. Am J Respir Crit Care Med 2015;191:1310–17.
- Park TY, et al. PLoS One 2017;12:e0185774.
- Hoefsloot W, et al. Eur Respir J 2013;42:1604–13.
- Daley CL, et al. Clin Infect Dis 2020a;71:e1–e36.
- Diel R, et al. BMC Infect Dis 2018;18:206.
- Terzikhan N, et al. Eur J Epidemiol 2016;31:785–92.
- Snell N, et al. Respir Med 2019;158:212–3.
- Chalmers JD, et al. Pulmonol 2018;24:120–31.
- Chalmers JD, et al. Chest 2018;165:1272–3.
- Taira N, et al. Am J Case Rep 2018;19:748–51.
- Yeung MY, et al. Respirology 2016;21:1015–25.
- Park CS, et al. Sci Rep 2019;9:15503.
- Kotilainen H, et al. Eur J Clin Microbiol Infect Dis 2015;34:1909–18.
- Liu C-J, et al. Respir Med 2019;151:19–26.
- Zweijpfenning SM, et al. Semin Respir Crit Care Med 2018;39:336–42.
- Aksamit TR, et al. Chest 2017;151:982–92.
- Andrejak C, et al. Thorax 2013;68:256–62.
- Jones MM, et al. PLoS One 2018;13:0197976.
- Dirac MA, et al. Am J Respir Crit Care Med 2012;186:684–91.
- Winthrop KL, et al. Ann Rheum Dis 2013;72:37–42.
- Brode SK, et al. Thorax 2015;70:677–82.
- Wu UI, et al. Lancet Infect Dis 2015;15:968–80.
- Szymanski EP, et al. Am J Respir Crit Care Med 2015;192:618–28.
- Kim RD, et al. Am J Respir Crit Care Med 2008;178:1066–74.
- Holt MR, et al. Eur Respir J 2019;54:1900252.
- Henkle E, et al. Clin Chest Med 2015;36:91–9.
- Ose N, et al. Surg Case Rep 2019;5:11.
- Friedman DZP, et al. Transpl Infect Dis 2020;22:e13229.
- Chao WC, et al. BMC Infect Dis 2017;17:796.
- Ku JH, et al. Diagn Microbiol Infect Dis 2020;96:114916.
- Prevots DR, et al. Am J Respir Crit Care Med 2010;182:970–6.
- Prevots DR, et al. Clin Chest Med 2015;36:13–34.
- Smith D, et al. BMJ Open 2020;7:e000489.
- Haworth C, et al. Thorax 2017;72:ii1–ii64.
- Awuh JA, et al. Cell Mol Life Sci 2017;74:1625–48.
- Ganbat D, et al. BMC Pulm Med 2016;16:19.
- Esteban J, et al. Front Microbiol 2018;8:2651.
- Chakraborty P, et al. Microbiol Cell 2019;6:105–22.
- McGarvey, et al. Clin Chest Med 2002;23:569–83.
- Chiplunkar SS, et al. Future Microbiol 2019;14:293–313.
- Gomes MS, et al. Infect Immun 1999;67:3199–206.
- Lee K-I, et al. Sci Rep 2016;6:37804.
- Global Burden of Disease 2015 Chronic Respiratory Disease Collaborators. Lancet Respir Med 2017;5:691–706.
- Lopez-Campos J, et al. Respirology 2016;21:14–23.
- Redondo M, et al. Breathe 2016;12:222–35.
- Diel R, et al. Eur Resp J 2017;49:1602109.
- Fleshner M, et al. Int J Tuberc Lung Dis 2016;20:582–7.
- Mehta M, et al. Respir Med 2011;105:1718–25.
- Fukushima K, et al. J Clin Med 2020;9:1315.
- Olivier KN, et al. Am J Respir Crit Care Med 2003;167:828–34.
- Roux A-L, et al. J Clin Microbiol 2009;47:4124–8.
- Hojo M, et al. Respirology 2012;17:185–90.
 Medical writing and editorial support was provided by Highfield, Oxford, UK. This support was sponsored by Insmed.
Medical writing and editorial support was provided by Highfield, Oxford, UK. This support was sponsored by Insmed.
Benefits of early treatment initiation in non-tuberculous mycobacterial pulmonary disease (NTM-PD)
Treatment of non-tuberculous mycobacterial pulmonary disease (NTM-PD) with antimicrobial agents offers the possibility of cure.1 In patients who meet the clinical, radiographical and microbiological diagnostic criteria for NTM-PD, the 2020 ATS/ERS/ESCMID/IDSA clinical practice guideline for NTM-PD recommend initiation of treatment rather than watchful waiting.1 Initiation is especially important in the context of positive acid-fast bacilli sputum smears and/or cavitary lung disease1as there may be an increased rate of progression and poor treatment outcomes if treatment is delayed.1
Evidence of disease progression in untreated MAC-PD
Several studies have shown that most patients diagnosed with Mycobacterium avium complex pulmonary disease (MAC-PD) have progressive disease resulting in the need for antibiotic treatment.2,3 In a recent study of 488 newly diagnosed patients at the Asan Medical Center in South Korea, 305 (62.5%) patients showed progressive MAC-PD resulting in treatment initiation within 3 years of diagnosis.2 Similarly, in another study of 40 untreated patients with the nodular bronchiectatic form of MAC-PD (most with minimal symptoms), who underwent serial chest computed tomography (CT) scans for a minimum of 4 years, 39 (97.5%) experienced disease progression with a significant increase in overall CT score.3 It is noted in the 2020 NTM-PD guidelines that some subgroups (minimal nodular/bronchiectatic disease) may be safely, but regularly, followed without antimicrobial therapy; however, those with cavity disease should always receive prompt antibiotic treatment.1
Factors influencing the decision to initiate treatment
The decision to treat may be influenced by both host factors and infecting bacterial species. Certain factors like cavitary disease and low body mass index have been associated with progressive disease and may necessitate earlier consideration of antibiotic treatment.2 In very frail patients with very mild nodular bronchiectatic disease, the balance between efficacy and tolerability may favour watchful waiting.1
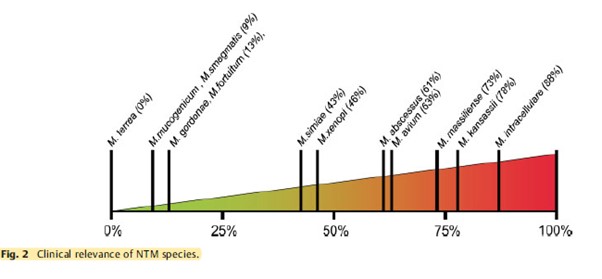
The clinical relevance of NTM varies significantly between species (Figure 1) and may also differ geographically.1,4 For example, species such as M. gordonae have low pathogenicity and rarely cause disease in humans, whereas M. kansasii is highly pathogenic.1,4
Figure 1. Clinical relevance (the percentage of patients with isolates of these species that meet the ATS/IDSA diagnostic criteria) of non-tuberculous mycobacterial species. M., Mycobacterium. Adapted from Zweijpfenning (2018).5

The most common NTM pathogens include MAC, M. kansasii and M. xenopi among the slowly growing NTM and M. abscessus among the rapidly growing NTM.1
Meeting the guideline-recommended diagnostic criteria for NTM-PD
Diagnostic criteria within the guideline is based on:
- Clinical symptoms e.g. worsening of symptoms of underlying lung conditions, or onset of new, persistent symptoms in patients at risk of NTM-PD e.g. haemoptysis, weight loss, fatigue
- Radiological findings on X-ray or hight-resolution CT scan such as nodular or cavitary opacities
- Microbiological findings from a) at least two expectorated sputum or b) positive culture from at least one bronchial wash or lavage or c) positive culture for NTM and biopsy from transbronchial or lung biopsy plus one or more culture positive sputa or bronchial washing.
Patients suspected of having NTM-PD who do not meet the diagnostic criteria should be actively managed and followed with serial CT scans until the diagnosis is firmly established or excluded and should start or continue recommended techniques such as airway clearance.6
The decision to initiate antibiotic treatment
NTM-PD is associated with diminished health-related quality of life that correlates with severity of lung impairment;7 antimicrobial treatment may be associated with improvement.8
NTM-PD treatment decisions are often difficult and require experience in managing the disease. This can mean that it may be necessary for a peer consultation or referral to a pulmonologist or infectious disease specialist with experience in NTM-PD.1,9 The virulence and potential for progressive disease must be evaluated once the NTM species is identified in order to determine treatment. In the 2020 ATS/ERS/ESCMID/IDSA clinical practice guideline for NTM-PD for example, it is recommended that for species of low pathogenicity such as M. gordonae, treatment is only indicated if repeated positive cultures over several months are observed, along with strong clinical and radiological evidence of disease whereas in many patients only one positive M. kansasii sputum culture may be required in order to initiate treatment.1 Similarly, clinically significant MAC-PD is unlikely in patients who have a single positive sputum culture during the initial evaluation but can be as high as 98% in those with ≥2 positive cultures.1 Two or more MAC-positive cultures indicate active MAC infection requiring a treatment decision, whereas for patients identified with M. kansasii, treatment should be initiated as soon as a single positive culture is obtained.1
Regardless of the infecting organism, the decision to initiate antibiotic treatment should be individualised considering the patient’s symptoms, the pathogenicity of the organism, radiological findings, microbiological results and importantly, the patient’s wish and ability to receive treatment as well as the goals of therapy.1 Any treatment decision should include a discussion with the patient that outlines the potential side-effects of antimicrobial therapy, the uncertainties surrounding the benefits of antimicrobial therapy and the potential for recurrence including reinfection (particularly in the setting of nodular/bronchiectatic disease).1 Guidelines recommend regular sputum cultures and routine monitoring to assess disease progression.1
 Following treatment initiation, sputum specimens should be obtained for culture every 1 to 2 months to document when sputum cultures become negative and to survey for the appearance of other organisms. 1
Following treatment initiation, sputum specimens should be obtained for culture every 1 to 2 months to document when sputum cultures become negative and to survey for the appearance of other organisms. 1
Clinical and radiographical assessments should be performed alongside the microbiological assessments to determine if the patient is responding to therapy.1
Retrospective studies have shown that most patients with MAC-PD who convert on treatment do so within 6 months of starting treatment.11–13
If you decide not to initiate antibiotic treatment, an active monitoring plan is recommended by the guidelines.1 Study data suggest that untreated NTM-PD could progress.2,3
Βιβλιογραφία:
- Daley Cl, et al. Clin Infect Dis 2020;71:e1–e36.
- Hwang JA, et al. Eur Respir J 2017;49:1600537.
- Park TY, et al. PLoS One 2017;12:e0185774.
- van Ingen J, et al. Thorax 2009;64:502–6.
- Zweijpfenning SMH, et al. Semin Respir Crit Care Med 2018;39:336–42.
- Lipman M, et al. BMJ Open Respir Res 2020 ;7 :e000591
- Mehta M, Marras TK. Respir Med 2011;105:1718–25.
- Czaja CA, et al. Ann Am Thorac Soc 2016;13:40–8.
- Ryu YJ, et al. Tuberc Respir Dis 2016;79:74–84.
- Lee MR, et al. Clin Microbiol Infect 2015;21:250.e1–250.e7.
- Furuuchi K, et al. Chest 2020;157:1442–5.
- Koh WJ, et al. Eur Respir J 2017;50:1602503.
- Moon SM, et al. Eur Respir J 2019;53;1801636.
![]() Medical writing and editorial support was provided by Highfield, Oxford, UK. This support was sponsored by Insmed.
Medical writing and editorial support was provided by Highfield, Oxford, UK. This support was sponsored by Insmed.
,
Thank you for registering your interest
Sorry, an error has occurred: