Βέλτιστη πρακτική
Η προσέγγιση για τη διαχείριση της πνευμονικής νόσου από μη φυματικά μυκοβακτηρίδια (NTM-PD) θα πρέπει να είναι πολυδιάστατη και, εκτός από τα κατάλληλα φαρμακολογικά σχήματα και την παρακολούθηση, θα πρέπει να περιλαμβάνει μη φαρμακευτική και ολιστική ιατρική προκειμένου να υποστηριχθούν οι ασθενείς
Λαμβάνοντας υπόψη την περίπλοκη φύση της NTM-PD, η διαχείριση θα πρέπει να διεξάγεται από μια διεπιστημονική ομάδα ειδικών και να περιλαμβάνει αρκετά βήματα, όπως η συμβουλευτική και η εκπαίδευση των ασθενών, μη φαρμακολογικές θεραπείες όπως η κάθαρση των αεραγωγών, φαρμακολογικά θεραπευτικά σχήματα και συνεχή παρακολούθηση των ασθενών.
Ταυτοποίηση ασθενών
Για να διαγνωσθεί η NTM-PD σε έναν ασθενή, αυτός πρέπει να πληροί ορισμένα κλινικά, απεικονιστικά και μικροβιολογικά κριτήρια.1 Για τη διάγνωση πρέπει να πληρούνται τόσο τα κλινικά όσο και τα απεικονιστικά κριτήρια, καθώς και να έχουν αποκλειστεί κατάλληλα τυχόν άλλες νόσοι. Στα μικροβιολογικά κριτήρια θα πρέπει να περιλαμβάνεται ένα από τα ακόλουθα:2
- δύο ή περισσότερες θετικές καλλιέργειες πτυέλων
- τουλάχιστον ένα θετικό δείγμα βρογχικού/βρογχοκυψελιδικού εκπλύματος
- συμβατά ιστοπαθολογικά ευρήματα με μία θετική καλλιέργεια του ίδιου είδους NTM
Κατά γενικό κανόνα, για την μικροβιολογική διάγνωση απαιτούνται δείγματα πρωινών πτυέλων και στις δοκιμασίες να περιλαμβάνονται τα ακόλουθα:3
- οξεάντοχη χρώση των βακίλλων (AFB)
- μοριακά τεστ όπως τεστ ενίσχυσης νουκλεϊκού οξέος (NAAT)
- καλλιέργεια οξεάντοχων βακτηρίων
- αντιμικροβιακός έλεγχος ευαισθησίας
Μόλις γίνει η διάγνωση της NTM-PD, με βάση τις συστάσεις των κατευθυντήριων οδηγιών, για ορισμένα είδη NTM και σε ορισμένες περιστάσεις η θεραπεία πρέπει να ξεκινά άμεσα. Μεταξύ των ασθενών που πρέπει να λάβουν άμεσα θεραπεία σύμφωνα με τις κατευθυντήριες οδηγίες περιλαμβάνονται, όσοι έχουν στελέχη NTM με υψηλή λοιμογονικότητα στους οποίους είναι πιθανό να υπάρξει προοδευτική εξέλιξη της νόσου, όσοι έχουν θετική οξεάντοχη χρώση και ασθενείς με ινωτικές και κοιλοτικές βλάβες. Έχει αποδειχτεί ότι, σε περίπτωση που δεν αντιμετωπιστεί, η πνευμονική νόσος από σύμπλεγμα ΜAC (MAC-PD) εξελίσσεται προοδευτικά στο 97,5% των ασθενών σε διάρκεια 6 ετών.4 Σε μια μελέτη, για τους ασθενείς με πνευμονική νόσο από M. kansasii, η πρόγνωση ήταν ακόμα χειρότερη, με διάμεση επιβίωση 71 ημερών και εκτιμώμενο ποσοστό θνητότητας στο 1 έτος 43%.5
Διεπιστημονικές ομάδες (MDT)
Η διαχείριση της NTM-PD θα πρέπει να τελεί υπό την επίβλεψη μιας ομάδας MDT με μακρά εμπειρία στην πνευμονική νόσο.2 Οι ομάδες MDT θα πρέπει να απαρτίζονται ιδανικά από τα ακόλουθα μέλη:
- πνευμονολόγος
- μικροβιολόγος
- εξειδικευμένος φαρμακοποιός
- εξειδικευμένος νοσηλευτής
- εξειδικευμένος φυσικοθεραπευτής
- ακτινολόγος
Ο πνευμονολόγος θα είναι υπεύθυνος για τη διερεύνηση των θεραπευτικών επιλογών, τη συνεχή παρακολούθηση της νόσου και τη βελτίωση υποκείμενων συννοσηροτήτων όπως οι βρογχεκτασίες. Σε ορισμένες πλευρές της διαχείρισης μπορούν να βοηθήσουν κι άλλοι ειδικοί, όπως στη διάγνωση, στα θεραπευτικά σχήματα, στην εκπαίδευση του ασθενή και στις φυσικοθεραπευτικές παρεμβάσεις.
Φαρμακευτική θεραπεία
Για τους ασθενείς που πληρούν τα διαγνωστικά κριτήρια της NTM-PD, οι κατευθυντήριες οδηγίες των ATS/ERS/ESCMID/IDSA του 2020 συστήνουν σε ορισμένα περιστατικά άμεση έναρξη της θεραπείας αντί για επαγρύπνηση και στάση αναμονής.1 Κατά την κατάστρωση ενός θεραπευτικού πλάνου, συστήνεται να λαμβάνονται υπόψιν αρκετοί παράγοντες που σχετίζονται με τον ασθενή. Αυτοί συμπεριλαμβάνουν τους ακόλουθους:1,6
- το είδος NTM
- τη σοβαρότητα της νόσου
- τον κίνδυνο προοδευτικής εξέλιξης της νόσου
- την παρουσία συννοσηροτήτων
- τους στόχους της θεραπείας
Θεραπευτικά σχήματα
Το εκάστοτε βέλτιστο θεραπευτικό σχήμα διαφέρει ανάλογα με το είδος NTM. Τα θεραπευτικά σχήματα με μακρολίδες θα πρέπει να περιλαμβάνουν τουλάχιστον τρία φάρμακα και θα πρέπει να διενεργείται δοκιμασία ευαισθησίας in vitro , προκειμένου να ανιχνεύεται τυχόν αντοχή στο φάρμακο.1
Συνιστώμενα θεραπευτικά σχήματα NTM-PD με βάση τις κατευθυντήριες οδηγίες1
|
|
Σύμπλεγμα Mycobacterium avium |
Mycobacterium kansasii |
Mycobacterium xenopi |
Mycobacterium abscessus |
||
|
Ευαισθησία σε μακρολίδες |
Αντοχή σε μακρολίδες |
Ευαισθησία σε ριφαμπικίνη |
Αντοχή σε ριφαμπικίνη |
|||
|
Θεραπευτικό σχήμα |
Μια μακρολίδη (κατά προτίμηση, αζιθρομυκίνη) Εθαμβουτόλη Ριφαμπικίνη
|
Μια μακρολίδη (κατά προτίμηση, αζιθρομυκίνη) Εθαμβουτόλη Ριφαμπικίνη Παρεντερική αμικασίνη ή στρεπτομυκίνη (αρχική θεραπεία για 2–3 μήνες) |
Ριφαμπικίνη Εθαμβουτόλη Ισονιαζίδη ή μια μακρολίδη
|
Ριφαμπικίνη Εθαμβουτόλη Ισονιαζίδη ή μια μακρολίδη Φθοριοκινολόνη (π.χ. μοξιφλοξασίνη) |
Ριφαμπικίνη Εθαμβουτόλη Μια μακρολίδη και/ή μια φθοριοκινολόνη (συνιστάται η μοξιφλοξασίνη)
|
Θα πρέπει να σχεδιάζεται σε συνεργασία με ειδικούς και να περιλαμβάνει τουλάχιστον τρία φάρμακα, όπως τα ακόλουθα: Παρεντερική αμικασίνη Ιμιπενέμη (ή κεφοξιτίνη) Τιγεκυκλίνη Μια μακρολίδη Κλοφαζιμίνη Λινεζολίδη
|
|
Συχνότητα χορήγησης |
Καθημερινά για σοβαρού βαθμού νόσο/ νόσο με κοιλοτικές βλάβες ή 3 φορές την εβδομάδα για νόσο οζιδιακής/ βρογχεκτασικής μορφής
|
Καθημερινά για σοβαρού βαθμού νόσο/ νόσο με κοιλοτικές βλάβες ή 3 φορές την εβδομάδα για νόσο οζιδιακής/ βρογχεκτασικής μορφής
|
Καθημερινά |
Θα καθορίζεται σε συνεργασία με τους ειδικούς |
||
|
Διάρκεια θεραπείας |
Για τουλάχιστον 12 μήνες μετά την αρνητικοποίηση της καλλιέργειας |
Τουλάχιστον 12 μήνες συνολικά |
Για τουλάχιστον 12 μήνες μετά τη μετατροπή της καλλιέργειας |
Θα καθορίζεται ανάλογα με το περιστατικό με συμμετοχή ειδικού |
||
|
Σημειώσεις |
Η εισπνεόμενη λιποσωμιακή αμικασίνη (ALIS) θα προστίθεται εφόσον δεν υπάρχει επί έξι μήνες μετατροπή της καλλιέργειας |
Η παρεντερική αμικασίνη και η στρεπτομυκίνη δεν συνιστώνται για την τυπική θεραπεία της πνευμονικής νόσου από M. kansasii. |
Η παρεντερική αμικασίνη θα πρέπει να προστίθεται στο σχήμα για νόσο με κοιλοτικές αλλοιώσεις ή για νόσο σοβαρού βαθμού/ βρογχεκτασικής μορφής. |
Οι μακρολίδες δεν θα πρέπει να λαμβάνονται υπόψη ως δραστικό φάρμακο στο θεραπευτικό σχήμα για στελέχη με επαγώμενη αντοχή ή λόγω μετάλλαξης αντοχή στις μακρολίδες |
||
Χειρουργική επέμβαση

Η χειρουργική εκτομή ίσως να είναι κατάλληλη για ορισμένους ασθενείς, όπως αυτούς που πληρούν τα ακόλουθα κριτήρια:1
- αποτυχία ιατρικής διαχείρισης
- νόσος με κοιλοτικές βλάβες
- απομονωμένων στελεχών ανθεκτικών σε φάρμακα
- επιπλοκές όπως σοβαρού βαθμού βρογχεκτασίες
Η απόφαση για υποβολή σε χειρουργείο πρέπει να αξιολογείται ανάλογα με τους κινδύνους και τα οφέλη της επέμβασης και απαιτεί την συμβουλή ειδικού.
Υποστήριξη ασθενών
Μόλις γίνει η διάγνωση της NTM-PD, ασθενείς και ιατροί θα πρέπει να συνεργαστούν, προκειμένου να είναι εφικτή η διαχείριση της νόσου και να αποκομιστούν τα μέγιστα οφέλη από τη θεραπεία. Για την αποτελεσματική διαχείριση της NTM-PD, οι ασθενείς θα πρέπει να λαμβάνουν εκπαίδευση και υποστήριξη καθ’ όλη τη διάρκεια της θεραπείας και κατά τη μετέπειτα παρακολούθηση.
Ψυχολογική υποστήριξη
Η NTM-PD είναι μια χρόνια ασθένεια που δυστυχώς δεν έχει γίνει ακόμα επαρκώς κατανοητή, με μακροχρόνια θεραπεία που πιθανώς να προκαλέσει ή να ενισχύσει αρνητικά συναισθήματα όπως το άγχος ή η κατάθλιψη.2,9 Αυτό μπορεί να έχει αρνητικό αντίκτυπο στην συμμόρφωση στην φαρμακευτική αγωγή, αλλά και στην ποιότητα ζωής (QoL). Συνεπώς, οι ασθενείς μπορεί να επωφεληθούν από τις παρεμβάσεις ενός ψυχολόγου που θα τους βοηθήσει να περιορίσουν αυτά τα αρνητικά συναισθήματα.
Εκπαίδευση
Οι ασθενείς με NTM-PD θα πρέπει να λαμβάνουν σχετική εκπαίδευση, προκειμένου να κατανοήσουν καλύτερα και, επομένως, να διαχειριστούν και αποτελεσματικότερα τη νόσο NTM-PD και συνδεόμενες ασθένειες όπως τις βρογχεκτασίες.7 Η εκπαίδευση πρέπει να είναι προσαρμοσμένη στις προσωπικές ανάγκες κάθε ασθενή και μπορεί να καλύπτει τα παρακάτω θέματα:
- ενημέρωση για τη νόσο
- τεχνικές κάθαρσης αεραγωγών
- τεχνικές αυτοφροντίδας, όπως η βελτίωση της διατροφής
- φαρμακευτική θεραπεία
- μη φαρμακευτική θεραπεία
- διακοπή καπνίσματος
- ανακουφιστική φροντίδα των ασθενών τελικού σταδίου σε ξενώνες
Παρακολούθηση βιολογικών παραμέτρων
Παρακολούθηση βιολογικών παραμέτρων
Μετά την έναρξη της θεραπείας, είναι σημαντικό να συλλέγονται κλινικά, απεικονιστικά και μικροβιολογικά δεδομένα προκειμένου να εκτιμηθεί η ανταπόκριση στη θεραπεία.1 Για τον καθορισμό της διάρκειας θεραπείας και της χρονικής στιγμής μετατροπής της καλλιέργειας, θα πρέπει να συλλέγονται καλλιέργειες πτυέλων κάθε έναν με δύο μήνες. Ακόμα και οι ασθενείς που δεν λαμβάνουν άμεση φαρμακευτική θεραπεία θα πρέπει να ελέγχονται για προοδευτική εξέλιξη της νόσου με καλλιέργειες πτυέλων και τακτική παρακολούθηση.
Παρακολούθηση ανεπιθύμητων ενεργειών
Οι ανεπιθύμητες ενέργειες και η μη ανοχή στα φαρμακευτικά σχήματα είναι σύνηθες φαινόμενο στη θεραπεία των NTM, συνεπώς οι ασθενείς θα πρέπει να εκπαιδεύονται σχετικά με τις ενδεχόμενες παρενέργειες και να παρακολουθούνται συστηματικά για ανεπιθύμητες ενέργειες από το φάρμακο.1 Η συχνότητα παρακολούθησης για ανεπιθύμητες ενέργειες θα αποφασίζεται με βάση την ηλικία του ασθενή, τις συννοσηρότητες, την ταυτόχρονη χρήση άλλων φαρμάκων, την αθροιστική συνέργεια όταν συγχορηγούνται φάρμακα και τις δυνατότητες που υπάρχουν.
Η εκπαίδευση των ασθενών για τις παρενέργειες, καθώς και στο τι να προσδοκούν από τη θεραπεία μπορεί να τους βοηθήσει να φτάσουν και έως το τέλος της. Ασθενείς που έλαβαν θεραπεία για λιγότερο από 15 μήνες μετά τη μετατροπή της καλλιέργειας είχαν δύο φορές περισσότερες πιθανότητες να παρουσιάσουν υποτροπή σε σύγκριση με εκείνους που έλαβαν θεραπεία για 15 μήνες ή μεγαλύτερο χρονικό διάστημα.8
Μη φαρμακευτική θεραπεία
Πέρα από τη θεραπεία για την πνευμονική λοίμωξη, οι ασθενείς θα πρέπει να λαμβάνουν και μη φαρμακευτική θεραπεία για άλλα θέματα που σχετίζονται με τη NTM-PD.9 Η μη φαρμακευτική θεραπεία μπορεί να συμβάλει στη βελτίωση των συμπτωμάτων, καθώς και στην υγεία ζωής (HRQoL).7




Μη φαρμακευτική θεραπεία
Η NTM-PD είναι μια χρόνια ασθένεια που δυστυχώς δεν έχει γίνει ακόμα επαρκώς κατανοητή, με μακροχρόνια θεραπεία που πιθανώς να προκαλέσει ή να ενισχύσει αρνητικά συναισθήματα όπως το άγχος ή η κατάθλιψη.2,9 Αυτό μπορεί να έχει αρνητικό αντίκτυπο στην συμμόρφωση στην φαρμακευτική αγωγή, αλλά και στην ποιότητα ζωής (QoL). Συνεπώς, οι ασθενείς μπορεί να επωφεληθούν από τις παρεμβάσεις ενός ψυχολόγου που θα τους βοηθήσει να περιορίσουν αυτά τα αρνητικά συναισθήματα.
Οι ασθενείς ενδέχεται επίσης να επωφεληθούν από τη συμμετοχή σε συλλόγους υποστήριξης ασθενών όπως οι NTM Info & Research (https://ntminfo.org/?lang=de) και NTM Patient Care UK (https://www.ntmpatientcare.uk/), οι οποίοι παρέχουν εκπαίδευση και στήριξη στους ασθενείς με NTM-PD.
Κάθαρση αεραγωγών
Η κάθαρση των αεραγωγών συνιστά σημαντικό μέρος της διαχείρισης NTM και θα πρέπει να εξετάζεται ως επιλογή για ασθενείς με NTM-PD οι οποίοι έχουν σημαντική παραγωγή εκκρίσεων και προβλήματα κάθαρσης.6 Η κάθαρση των αεραγωγών μπορεί να μειώσει τα αναπνευστικά συμπτώματα και την έκπτωση της αναπνευστικής λειτουργίας, να αυξήσει την απόχρεμψη πτυέλων και να βελτιώσει την HRQoL.7 Στις τεχνικές κάθαρσης αεραγωγών περιλαμβάνονται:
- εισπνοή υπέρτονου αλατούχου διαλύματος
- ενεργητικός κύκλος τεχνικών αναπνοής
- αυτογενής παροχέτευση
- τεχνικές βεβιασμένης εκπνοής
- χειρωνακτικές τεχνικές
- βρογχική παροχέτευση
- κατάλληλη ενυδάτωση
- θετική εκπνευστική πίεση
- θετική εκπνευστική πίεση με ταλάντωση
- ταλάντωση θωρακικού τοιχώματος σε υψηλές συχνότητες
Διατροφή και δίαιτα
Οι ασθενείς με NTM-PD παρουσιάζουν σημαντική απώλεια βάρους και μυϊκής μάζας, γεγονός που οδηγεί σε φτωχότερα αποτελέσματα στη διάρκεια της θεραπείας.7 Για τους υποσιτιζόμενους ασθενείς (δείκτης μάζας σώματος [BMI]<20 kg/m2, αλβουμίνη ορού <3,5 g/dL), θα πρέπει να εφαρμόζεται διατροφή σε συνδυασμό με σωματική δραστηριότητα, που θα στοχεύει στη μυϊκή ενδυνάμωση και τη βελτίωση της HRQoL και μπορεί να περιλαμβάνει:
- υψηλή πρόσληψη θερμίδων/ υψηλή περιεκτικότητα σε πρωτεΐνη
- φρούτα και λαχανικά
- συμπληρώματα βιταμινών και μεταλλικών στοιχείων
- συμπληρώματα διατροφής από του στόματος
Άσκηση
Στους ασθενείς με NTM-PD, η γυμναστική μπορεί να επιφέρει βελτιώσεις στην HRQoL και στην αντοχή στην άσκηση, καθώς και να μειώσει τις οξείες παροξύνσεις και τη δύσπνοια.7 Το πρόγραμμα άσκησης θα πρέπει να είναι εξατομικευμένο, αλλά μπορεί να περιλαμβάνει:
- ποδηλασία
- τρέξιμο
- περπάτημα
- κολύμπι
- ασκήσεις ενδυνάμωσης (με βάρη χειρός ή λάστιχα)
Σχετικές πηγές

Άρθρο
Κατανοώντας τις βέλτιστες πρακτικές στην πνευμονική νόσο από το σύμπλεγμα MAC (MAC-PD)
Read time: 10 mins
Η θεραπεία της πνευμονικής νόσου από μη φυματικά μυκοβακτηρίδια (NTM-PD) ποικίλλει ανάλογα με το είδος των μυκοβακτηριδίων, την έκταση της νόσου, τα αποτελέσματα από τη δοκιμή ευαισθησίας σε αντιφυματικά φάρμακα και υποκείμενες συννοσηρότητες.

Βίντεο
Κατευθυντήριες οδηγίες ATS/ERS/ESCMID/IDSA για τη NTM-PD 2020 – Παρουσίαση ειδικών
Stefano Aliberti, Christoph Lange, Eva Polverino, Nicolas Veziris, Charles Haworth and Jakko van Ingen
Η πνευμονική νόσος από μη φυματικά μυκοβακτηρίδια (NTM-PD) εμφανίζεται όλο και συχνότερα και μπορεί να οδηγήσει στον θάνατο. Οι διεθνείς κατευθυντήριες οδηγίες του 2020 παρέχουν συστάσεις σχετικά με τα τέσσερα συχνότερα λοιμογόνα είδη NTM.

Άρθρο
Read time: 5 mins
Η αντιμετώπιση της πνευμονικής νόσου από μη φυματικά μυκοβακτηρίδια (NTM-PD) με αντιμικροβιακούς παράγοντες προσφέρει τη δυνατότητα της ίασης. Σε ασθενείς που πληρούν τα κλινικά, απεικονιστικά και μικροβιολογικά διαγνωστικά κριτήρια για NTM-PD.

Βίντεο
Κατευθυντήριες οδηγίες για τη NTM-PD – Βασικές συστάσεις
Σε αυτό το βίντεο, οι Ευρωπαίοι εμπειρογνώμονες παρέχουν τις γνώσεις τους σχετικά με τις οδηγίες ATS/ERS/ESCMID/IDSA 2020 για το NTM-PD, με έμφαση στο MAC-PD.
Μάθετε περισσότερα για την NTM-PD
Διερευνήστε ποιοι ασθενείς πρέπει να λάβουν θεραπεία και, εφόσον η απόφαση αυτή ληφθεί, πώς μπορεί να γίνει αυτό σύμφωνα με τις τρέχουσες κατευθυντήριες οδηγίες και συστάσεις
Μια συλλογή πηγών στην οποία μπορείτε να εκτελέσετε αναζήτηση και που περιλαμβάνει, μεταξύ άλλων, περιλήψεις πρόσφατων δημοσιεύσεων.
Βιβλιογραφία:
- Daley CL et al. Eur Respir J 2020;56:1000535.
- Lipman M et al. BMJ Open Respir Res 2020;7:e000591.
- Lab Tests Online. Non-tuberculous Mycobacteria Infections. https://labtestsonline.org/conditions/nontuberculous-mycobacteria-infections [Accessed March 2021].
- Park TY et al. PLoS One 2017;12(10):e0185774.
- Liu C-J et al. Respir Med 2019;151:19–26.
- Griffith DE et al. Am J Respir Crit Care Med 2007;175:367–416.
- Lan C-C et al. J Formos Med Assoc 2020;119:S42–S50.
- Furuuchi K et al. Chest 2020;157(6):1442–5.
- Henkle E et al. Ann Am Thorac Soc 2016;13(9):S379–84.
Understanding best practice in Mycobacterium avium complex pulmonary disease (MAC-PD)
Treatment of non-tuberculous mycobacterial pulmonary disease (NTM-PD) varies depending on the species, extent of disease, drug susceptibility results and underlying comorbidities.1 Mycobacterium avium complex (MAC) is the most common cause of disease and a multidrug antimicrobial regimen is recommended, first line, to avoid the development of resistance.1,2 Treatment is lengthy and adverse events are not uncommon; successful treatment requires good adherence, frequent monitoring and effective adverse event management.1,3
Initiation of treatment for MAC-PD
Treatment of MAC-PD with antimicrobial agents offers the possibility of cure of the disease.1 In patients who meet the diagnostic criteria (clinical symptoms, radiological evidence of nodules, bronchiectasis or cavitary opacity, and microbiological evidence of positive culture results from sputum), the ATS/ERS/ESCMID/IDSA 2020 NTM guidelines suggest initiation of treatment rather than watchful waiting, especially in the context of positive acid-fast bacilli sputum smears and/or cavitary lung disease.1 The decision to initiate antimicrobial therapy should nonetheless be individualised and based on a combination of clinical factors, the infecting species and individual patient priorities.1,4
Comprehensive care and good communication across a multidisciplinary team of healthcare providers is important because of the complexities of MAC-PD management and treatment.5–7 When initiating treatment, setting expectations for the patient is critical and it is important to discuss length of therapy, treatment response, follow-up appointments and potential adverse events.1
“One needs to discuss with the patient the likely side-effects of treatment, the likely success or failure of treatment and, of course, the potential for reinfection.” Charles Haworth, Royal Papworth Hospital, UK
“If you need to start treatment that you’re inexperienced with or you run into toxicity or other issues that you’re inexperienced in, consult centres of excellence in this field to improve management of the patient.” Jakko van Ingen, Radboud UMC, the Netherlands
Drug susceptibility testing for MAC-PD
Macrolide monotherapy is commonly prescribed in NTM-PD and can be a key driver in the development of macrolide-resistant strains, leading to poor outcomes for NTM treatment.8
Given the good correlation between in vitro activity and in vivo outcomes with macrolides9 and amikacin3 for MAC, the 2020 NTM guidelines recommend susceptibility-based treatment for macrolides and amikacin over empirical therapy for patients with MAC-PD.1 Recommendations, including protocols and related quality-control parameters, for the susceptibility testing of mycobacteria are provided by the Clinical and Laboratory Standards Institute (CLSI).10
“Drug susceptibility testing should be performed for the macrolides and amikacin before the onset of treatment.” Jakko van Ingen, Radboud UMC, the Netherlands
“For patients with MAC lung disease, it’s essential to perform drug susceptibility testing on isolates before you commence treatment. In particular, it’s crucial to know the macrolide susceptibility as that will influence the initial regimen and it’s also important to know the amikacin susceptibility, particularly in patients with severe disease or cavitary disease.” Charles Haworth, Royal Papworth Hospital, UK
Multidrug treatment regimen for MAC-PD
Patients respond best to MAC treatment regimens the first time they are administered; therefore, it is especially important that patients receive recommended multidrug therapy the first time they are treated for MAC-PD, especially as up to 45% of patients are known to fail first-line therapy.11–14
Macrolides (clarithromycin and azithromycin) are a key component of MAC-PD treatment based on data that shows poor patient outcomes if they are excluded.1 The 2020 NTM guidelines recommend treatment with at least three antimicrobials (Table 1) for macrolide-sensitive MAC-PD with the addition of parenteral amikacin or streptomycin in macrolide-insensitive disease or advanced bronchiectatic/cavitary disease.1
Macrolide resistance is associated with higher mortality rates than macrolide-sensitive disease, with one study suggesting a mortality rate of >45% over 5 years.8 Treating macrolide-resistant disease can be difficult and expert consultation should be sought.1
“The most important thing in treating macrolide-resistant MAC pulmonary disease is to look for help… seek expert consultation.” Jakko van Ingen, Radboud UMC, the Netherlands
Table 1. Guideline-based therapy for Mycobacterium avium complex pulmonary disease (MAC-PD).1
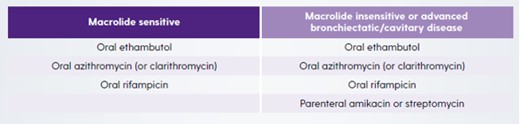
For both macrolide-sensitive and macrolide-insensitive disease, azithromycin is recommended over clarithromycin because of better tolerance, fewer drug interactions, lower pill burden and equal efficacy.1 However, when azithromycin is not available or not tolerated, clarithromycin is considered an acceptable alternative.1 Ethambutol is included in the recommendation as it is the most effective drug known to prevent the development of macrolide resistance.15,16
“The three-drug regimen should be based on azithromycin as the macrolide of choice, plus ethambutol as a second drug and a third companion drug, most likely being a rifamycin. In the case of severe disease, like fibro-cavitary disease or disease that affects both lungs, additional treatment with a parenteral aminoglycoside like streptomycin or amikacin should be considered.” Christoph Lange, Research Center Borstel, Germany
“The guidelines are very clear that azithromycin is preferable over clarithromycin in most circumstances and that’s because, on the whole, it’s better tolerated particularly from a gastrointestinal perspective, it’s once a day rather than twice a day and there are fewer drug–drug interactions, particularly with rifampicin.” Charles Haworth, Royal Papworth Hospital, UK
In patients with non-cavitary nodular/bronchiectatic disease a dosing regimen of three times per week is recommended but in patients with cavitary severe/advanced disease, treatment should be administered daily.1
Monitoring for treatment response in MAC-PD
The 2020 NTM guidelines recommend frequent follow-up visits after initiating treatment for MAC-PD, including obtaining sputum cultures every 1 to 2 months to determine if, and when, culture conversion occurs.1 Retrospective studies have shown that among the NTM-PD patients who convert on standard first-line multidrug treatment, the majority do so within 6 months of treatment initiation.17–19 In addition to microbiological assessments, clinical and radiographical findings should also be used to determine if the patient is responding to therapy.1
“One of the major mistakes done in the management of patients with Mycobacterium avium complex pulmonary disease or any other NTM pulmonary disease, is the lack of proper monitoring, for example monthly sputum collection for microscopy and culture.” Christoph Lange, Research Center Borstel, Germany
If patients do not respond as expected, therapeutic drug monitoring could be considered in situations where drug malabsorption, drug underdosing or clinically important drug–drug interactions are suspected.20
It is recommended that treatment should be maintained for at least 12 months after culture conversion to increase chances of treatment success.1 Of note, in a study of 154 patients with MAC-PD, those who were treated for <15 months after culture conversion were twice as likely to experience recurrence than those treated for ≥15 months post conversion.17
Management of patients with MAC-PD who fail to culture convert
Study data has shown that up to 45% of MAC-PD patients will fail to respond on standard first-line multidrug treatment.13,14 Non-conversion may be an early sign that the patient may have future radiographic progression and lung function decline.21,22
In cases of MAC-PD where sputum cultures do not convert after 6 months of treatment, the 2020 NTM guidelines recommend that Amikacin Liposomal Inhalation Suspension (ALIS) once daily is added to the regimen.1
“When mycobacterial cultures do not convert by 6 months on oral guideline-based therapy patients should be considered to receive amikacin liposomal inhalation suspension. This has been shown to increase the chances to achieve culture conversion by 12 months and the effect of culture conversion is sustained for at least 3 months past the end of therapy.” Christoph Lange, Research Center Borstel, Germany
In selected patients with failure of medical management, cavitary disease, drug-resistant isolates or complications such as severe bronchiectasis, surgical resection of the diseased lung may be appropriate. The risks and benefits of surgery should be weighed up and expert consultation sought.1
“Surgical resection of the most affected areas of the lung can help to achieve cure in patients.” Jakko van Ingen, Radboud UMC, the Netherlands
“In patients with macrolide-resistant MAC-PD, we should also consider the role of surgery. These patients should be discussed with an expert surgeon because in some cases surgery could be on top of treatment and could improve outcomes for patients with macrolide-resistant MAC-PD.” Stefano Aliberti, University of Milan, Italy
Monitoring for adverse reactions in treatment of MAC-PD
The drugs routinely used to treat MAC-PD are frequently associated with adverse reactions,1 as demonstrated in a recent randomised clinical trial where >90% of participants experienced an adverse event.3 Consequently, educating patients regarding potential adverse reactions and monitoring them are important components of patient management. Furthermore, rapid identification and management of an adverse reaction may decrease the risk of treatment discontinuation and possibly improve the chances of treatment completion.1 Where drug intolerance is suspected, some medications could be introduced gradually at 1- to 2-week intervals so that appropriate evaluations of tolerance can be performed.11 According to the ATS/ERS/ESCMID/IDSA 2020 guidelines, it is important to individualise the frequency of monitoring for adverse reactions based on patient age, comorbidities, concurrent drugs, overlapping drug toxicities and resources.1 It is recommended that patients should have a complete blood count, liver function tests and metabolic panel every 1–3 months in patients on oral therapy and weekly if on intravenous therapy.1 Depending on the antibiotics selected, there may be a need to refer to other specialists for routine monitoring, including an ophthalmologist for vision testing and an audiologist to take baseline audiograms and hearing tests (Table 2).1
“Blood monitoring is essential because many of the treatments are quite toxic, so you’ll do full blood counts to look for bone marrow toxicity, liver blood tests and renal monitoring…Depending on the regimen you may want to do an ECG, to check for QT prolongation and often we’ll do audiology in patients that are on azithromycin or amikacin, to look for evidence of hearing impairment.” Charles Haworth, Royal Papworth Hospital, UK
Table 2. Common adverse reactions associated with drugs used to treat Mycobacterium avium complex pulmonary disease (MAC-PD) and monitoring recommendations.1
|
Drug |
Adverse Reactions |
Monitoring |
|
Azithromycin/clarithromycin |
Gastrointestinal Tinnitus/hearing loss Hepatotoxicity Prolonged QTc |
Clinical monitoring Audiogram Liver function tests ECG (QTc) |
|
Ethambutol |
Ocular toxicity
Neuropathy |
Visual acuity and colour discrimination Clinical monitoring |
|
Rifampicin |
Hepatotoxicity Cytopenias Hypersensitivity Orange discoloration of secretions |
Liver function test Complete blood count Clinical monitoring |
|
IV Amikacin/Streptomycin |
Vestibular toxicity Ototoxicity Nephrotoxicity Electrolyte disturbances |
Clinical monitoring Audiograms BUN, creatinine Calcium, magnesium, potassium |
BUN, blood, urea, nitrogen; ECG, electrocardiogram.
Best practice beyond pharmacotherapy alone
Providing best practice in MAC-PD requires an holistic approach to patients that explores non-pharmacological interventions as well as medication regimens outlined in the ATS/ERS/ESCMID/IDSA 2020 guidelines.
From the point of diagnosis, patients should be encouraged to undertake airway clearance techniques in order to limit lung function decline.23 The patient journey for MAC-PD patients is long, and many will have lived with their condition for some time before diagnosis.24 Living with a chronic, potentially debilitating disease is hard for patients and has a negative impact on their quality of live. Psychological interventions may be relevant for these patients and should be considered. Similarly, it is known that low body mass index is a risk factor for NTM-PD and is often a clinical characteristic of these patients. In these patients, nutritional support is important and involving a nutritionist or dietician in the clinical team may be helpful as improving diet and stopping weight loss can help to counter low mood.23
Summary
Patients with MAC-PD often face a long and punishing treatment journey with lengthy and complex multidrug regimens, many of which are associated with adverse events that affect patient adherence. Best practice management for MAC-PD should consider all aspects of the patient’s journey from non-pharmacological interventions, such as airway clearance, through to collaboration with other specialists for example radiologists, respiratory physicians, psychologists, dieticians, specialist pharmacists, nurses and physiotherapists to optimise patient’s nutrition, sleep and mental state.
Βιβλιογραφία:
- Daley CL, et al. Eur Respir J 2020;56(1):2000535.
- Hoefsloot W, et al. Eur Respir J 2013;42:1604–13.
- Griffith DE, et al. Am J Respir Crit Care Med 2018;198:1559–69.
- Haworth C, et al. Thorax 2017;72:iii1-ii64.
- Ryu YJ, et al. Tuberc Respir Dis (Seoul) 2016;79:74–84.
- Yu JA, et al. Thorac Surg Clin 2012;22:277–85.
- van Ingen J. Semin Respir Crit Care Med 2013;34:103–9.
- Moon SM, et al. Antimicrob Agents Chemother 2016;60:6758–65.
- Kobashi Y, et al. J Infect Chemother 2006;12:195–202.
- Clinical and Laboratory Standards Institute. M48 - laboratory detection and identification of mycobacteria, 2nd edition 2018Clinical and Laboratory Standards Institute. M24 – Susceptibility Testing of Mycobacteria, Nocardia spp, and other Aerobic Actinomyces, 3rd edn. 2018.
- Griffith DE, et al. Am J Respir Crit Care Med 2007;175:367–416.
- Griffith DE, Aksamit TR. Curr Opin Infect Dis 2012;25:218–27.
- Fukushima K, et al. J Clin Med 2020;9:1315.
- Wallace RJ, et al. Chest 2014;146:276–82.
- Griffith DE, et al. Am J Respir Crit Care Med 2006;174:928–34.
- Morimoto K, et al. Ann Am Thorac Soc 2016;13:1904–11.
- Furuuchi K, et al. Chest 2020;157:1442–5.
- Koh WJ, et al. Eur Respir J 2017;50:1602503.
- Moon SM, et al. Eur Respir J 2019;53:1801636.
- Nahid P, et al. Clin Infect Dis 2016;63:e147–95.
- Park HY, et al. Chest 2016;150:1222–32.
- Pan SW, et al. Clin Infect Dis 2017;65:927–34.
- Lipman M, et al. BMJ Open Resp Res 2020;7:e000591.
- Kotilainen H, et al. Eur J Clin Microbiol Infect Dis 2015;34:1909–18.
 Medical writing and editorial support was provided by Highfield, Oxford, UK. This support was sponsored by Insmed.
Medical writing and editorial support was provided by Highfield, Oxford, UK. This support was sponsored by Insmed.
Benefits of early treatment initiation in non-tuberculous mycobacterial pulmonary disease (NTM-PD)
Treatment of non-tuberculous mycobacterial pulmonary disease (NTM-PD) with antimicrobial agents offers the possibility of cure.1 In patients who meet the clinical, radiographical and microbiological diagnostic criteria for NTM-PD, the 2020 ATS/ERS/ESCMID/IDSA clinical practice guideline for NTM-PD recommend initiation of treatment rather than watchful waiting.1 Initiation is especially important in the context of positive acid-fast bacilli sputum smears and/or cavitary lung disease1as there may be an increased rate of progression and poor treatment outcomes if treatment is delayed.1
Evidence of disease progression in untreated MAC-PD
Several studies have shown that most patients diagnosed with Mycobacterium avium complex pulmonary disease (MAC-PD) have progressive disease resulting in the need for antibiotic treatment.2,3 In a recent study of 488 newly diagnosed patients at the Asan Medical Center in South Korea, 305 (62.5%) patients showed progressive MAC-PD resulting in treatment initiation within 3 years of diagnosis.2 Similarly, in another study of 40 untreated patients with the nodular bronchiectatic form of MAC-PD (most with minimal symptoms), who underwent serial chest computed tomography (CT) scans for a minimum of 4 years, 39 (97.5%) experienced disease progression with a significant increase in overall CT score.3 It is noted in the 2020 NTM-PD guidelines that some subgroups (minimal nodular/bronchiectatic disease) may be safely, but regularly, followed without antimicrobial therapy; however, those with cavity disease should always receive prompt antibiotic treatment.1
Factors influencing the decision to initiate treatment
The decision to treat may be influenced by both host factors and infecting bacterial species. Certain factors like cavitary disease and low body mass index have been associated with progressive disease and may necessitate earlier consideration of antibiotic treatment.2 In very frail patients with very mild nodular bronchiectatic disease, the balance between efficacy and tolerability may favour watchful waiting.1
The clinical relevance of NTM varies significantly between species (Figure 1) and may also differ geographically.1,4 For example, species such as M. gordonae have low pathogenicity and rarely cause disease in humans, whereas M. kansasii is highly pathogenic.1,4
Figure 1. Clinical relevance (the percentage of patients with isolates of these species that meet the ATS/IDSA diagnostic criteria) of non-tuberculous mycobacterial species. M., Mycobacterium. Adapted from Zweijpfenning (2018).5

The most common NTM pathogens include MAC, M. kansasii and M. xenopi among the slowly growing NTM and M. abscessus among the rapidly growing NTM.1
Meeting the guideline-recommended diagnostic criteria for NTM-PD
Diagnostic criteria within the guideline is based on:
- Clinical symptoms e.g. worsening of symptoms of underlying lung conditions, or onset of new, persistent symptoms in patients at risk of NTM-PD e.g. haemoptysis, weight loss, fatigue
- Radiological findings on X-ray or hight-resolution CT scan such as nodular or cavitary opacities
- Microbiological findings from a) at least two expectorated sputum or b) positive culture from at least one bronchial wash or lavage or c) positive culture for NTM and biopsy from transbronchial or lung biopsy plus one or more culture positive sputa or bronchial washing.
Patients suspected of having NTM-PD who do not meet the diagnostic criteria should be actively managed and followed with serial CT scans until the diagnosis is firmly established or excluded and should start or continue recommended techniques such as airway clearance.6
The decision to initiate antibiotic treatment
NTM-PD is associated with diminished health-related quality of life that correlates with severity of lung impairment;7 antimicrobial treatment may be associated with improvement.8
NTM-PD treatment decisions are often difficult and require experience in managing the disease. This can mean that it may be necessary for a peer consultation or referral to a pulmonologist or infectious disease specialist with experience in NTM-PD.1,9 The virulence and potential for progressive disease must be evaluated once the NTM species is identified in order to determine treatment. In the 2020 ATS/ERS/ESCMID/IDSA clinical practice guideline for NTM-PD for example, it is recommended that for species of low pathogenicity such as M. gordonae, treatment is only indicated if repeated positive cultures over several months are observed, along with strong clinical and radiological evidence of disease whereas in many patients only one positive M. kansasii sputum culture may be required in order to initiate treatment.1 Similarly, clinically significant MAC-PD is unlikely in patients who have a single positive sputum culture during the initial evaluation but can be as high as 98% in those with ≥2 positive cultures.1 Two or more MAC-positive cultures indicate active MAC infection requiring a treatment decision, whereas for patients identified with M. kansasii, treatment should be initiated as soon as a single positive culture is obtained.1
Regardless of the infecting organism, the decision to initiate antibiotic treatment should be individualised considering the patient’s symptoms, the pathogenicity of the organism, radiological findings, microbiological results and importantly, the patient’s wish and ability to receive treatment as well as the goals of therapy.1 Any treatment decision should include a discussion with the patient that outlines the potential side-effects of antimicrobial therapy, the uncertainties surrounding the benefits of antimicrobial therapy and the potential for recurrence including reinfection (particularly in the setting of nodular/bronchiectatic disease).1 Guidelines recommend regular sputum cultures and routine monitoring to assess disease progression.1
 Following treatment initiation, sputum specimens should be obtained for culture every 1 to 2 months to document when sputum cultures become negative and to survey for the appearance of other organisms. 1
Following treatment initiation, sputum specimens should be obtained for culture every 1 to 2 months to document when sputum cultures become negative and to survey for the appearance of other organisms. 1
Clinical and radiographical assessments should be performed alongside the microbiological assessments to determine if the patient is responding to therapy.1
Retrospective studies have shown that most patients with MAC-PD who convert on treatment do so within 6 months of starting treatment.11–13
If you decide not to initiate antibiotic treatment, an active monitoring plan is recommended by the guidelines.1 Study data suggest that untreated NTM-PD could progress.2,3
Βιβλιογραφία:
- Daley Cl, et al. Clin Infect Dis 2020;71:e1–e36.
- Hwang JA, et al. Eur Respir J 2017;49:1600537.
- Park TY, et al. PLoS One 2017;12:e0185774.
- van Ingen J, et al. Thorax 2009;64:502–6.
- Zweijpfenning SMH, et al. Semin Respir Crit Care Med 2018;39:336–42.
- Lipman M, et al. BMJ Open Respir Res 2020 ;7 :e000591
- Mehta M, Marras TK. Respir Med 2011;105:1718–25.
- Czaja CA, et al. Ann Am Thorac Soc 2016;13:40–8.
- Ryu YJ, et al. Tuberc Respir Dis 2016;79:74–84.
- Lee MR, et al. Clin Microbiol Infect 2015;21:250.e1–250.e7.
- Furuuchi K, et al. Chest 2020;157:1442–5.
- Koh WJ, et al. Eur Respir J 2017;50:1602503.
- Moon SM, et al. Eur Respir J 2019;53;1801636.
![]() Medical writing and editorial support was provided by Highfield, Oxford, UK. This support was sponsored by Insmed.
Medical writing and editorial support was provided by Highfield, Oxford, UK. This support was sponsored by Insmed.
,
Thank you for registering your interest
Sorry, an error has occurred: